Integridad de los datos en el sector de las ciencias de la vida

Motivadas por el aumento del número de incumplimientos en la Industria Farmacéutica, las agencias reguladoras, FDA, MHRA, OMS y PIC/S han publicado en los últimos años orientaciones sobre cómo proceder para mantener la integridad de los datos críticos relacionados con la producción de sus productos.
En los últimos años, las agencias reguladoras han observado, durante las inspecciones, un aumento de las infracciones de BPx relacionadas con la integridad de los datos. Los problemas de integridad de los datos plantean riesgos para la seguridad, la eficacia y la calidad de los productos, asociados a una pérdida de confianza por parte de los organismos reguladores, los pacientes y los accionistas de las empresas.
Datos que deben preservarse en su integridad
La primera acción que se debe considerar en la búsqueda de la Integridad de los Datos es registrar la situación actual de la empresa, con un análisis del cumplimiento de las normas en la gestión de los datos críticos.
Posteriormente, es necesario un trabajo conjunto del equipo de validación y garantía de calidad en la elaboración de un análisis de riesgos para definir qué datos están relacionados con las Buenas Prácticas y con la liberación de lotes de medicamentos.
La especificación de los datos que deben incluirse en este proceso tiene como objetivo evitar que todos los datos de la empresa, incluso los que no están sujetos a las normas, se incluyan en el proceso de Garantía de Integridad, ya que esto aumentaría los costes y la burocratización del proceso de producción.Todos los datos finales relacionados con el proceso de producción, los metadatos, que contienen información sobre los datos brutos, deben formar parte del proceso de garantía de integridad.
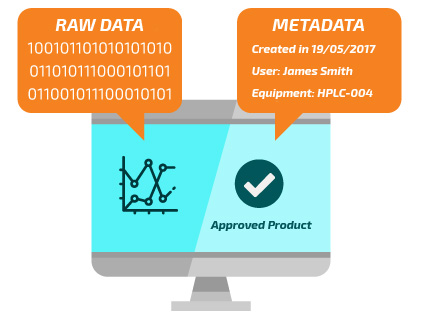
Datos maestros
RAW Data
Main Data
Para garantizar que el proceso de decisión está bien fundamentado y verificar que la información es fiable, los acontecimientos o acciones que conducen a tales decisiones deben estar bien documentados. Así pues, las Buenas Prácticas de Documentación son la clave para garantizar la integridad de los datos y una parte fundamental de un Sistema de Gestión de la Calidad estructurado.
Los datos que respaldan tales decisiones deben ser completos, así como precisos, legibles, actuales, originales y atribuibles. Estos principios básicos y las expectativas de BPx garantizan la fiabilidad de los datos y no son conceptos nuevos.
Ejemplos de datos brutos - Fotografías que acompañan a las declaraciones de productos, registros de control medioambiental y de calibración y cualificación de equipos, registros de limpieza y mantenimiento de equipos, registros de producción por lotes, transcripciones manuales de pantallas y equipos, cromatogramas de HPLC, registros de inventario, registros de formación.
Los planes maestros y los procedimientos deben considerar esta información, de modo que el Sistema de Calidad haya definido claramente qué datos estarán sujetos a las Mejores Prácticas de Integridad de Datos.
Características de una integridad de datos - FDA.
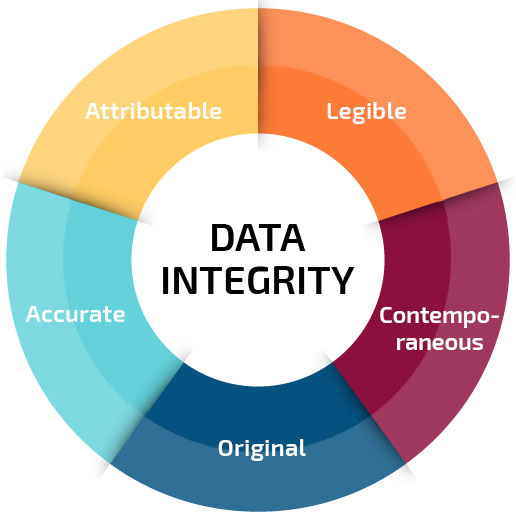
Atribuibles - Los datos generados o recopilados deben atribuirse a quién realizó la acción y cuándo se realizó. Esta atribución puede hacerse manualmente, mediante una firma y una fecha o electrónicamente mediante Audit Trail.
Legibles - Los datos recopilados deben registrarse de forma legible y permanente.
Contemporáneos - Los datos deben registrarse en el momento en que tiene lugar la acción.
Originales - Los datos deben registrarse directamente en el Libro de Registro oficial de la empresa, evitando anotaciones provisionales y la transcripción posterior de estos datos.
Precisos - Los datos generados deben estar libres de errores, ser completos y veraces, reflejando exactamente las acciones determinadas en el proceso productivo.
Concepto ALCOA + PIC/S
Completo
Coherente
Duradero
Disponible
Cómo puede contribuir el proceso a la integridad de los datos críticos

Mantener un reloj disponible en las áreas de actividad evita las entradas de tiempo erróneas. Una acción que contribuye al registro preciso de los datos.

Controlar el acceso a los sistemas informatizados prioriza la trazabilidad de los datos y garantiza que sean Atribuibles.

Facilitar el acceso del operario a los documentos relativos a las actividades que realiza, evita el registro de datos después de la acción, determinando que los datos no sean Contemporáneos.

Evitar la transcripción de datos utilizando impresoras conectadas directamente a los equipos garantiza que los datos sean Originales.

Controlar los formularios sin cumplimentar es una forma de minimizar los riesgos de cumplimentación incorrecta y evitar que los datos no sean Precisos.

Facilitar el acceso a los datos brutos a los responsables de su revisión minimiza los riesgos de que las agencias reguladoras indiquen alguna conformidad.
Cómo tratan el tema los reguladores y la industria
Las agencias reguladoras realizan auditorías centradas en la integridad de los datos y se comprometen a hacer un seguimiento de los casos de fraude en todo el mundo. Las agencias comparten entre sí los casos de incumplimiento para hacerse una idea global de cómo el sector ha gestionado el problema.
Para las industrias, es esencial invertir en la formación de los empleados para tratar los datos BPx pertinentes y crear en la empresa una cultura de atención a los procedimientos relacionados con la integridad de los datos críticos, de modo que los empleados se sientan responsables de la integridad de los datos generados en su área, producción o fase de análisis.

La tecnología se ha revelado como la mayor aliada de la transparencia y una herramienta fundamental para aumentar la fiabilidad e integridad de los datos.
Ahora es posible gestionar y ejecutar proyectos de validación/calificación utilizando GO!FIVE®, una Plataforma Digital de Conformidad (Digital Compliance Platform - DCP), donde los esfuerzos del experto se dedicarán a la evaluación de escenarios de riesgo, incluyendo mitigaciones, así como elementos de integridad de los datos, cuando sea posible.
Esta Plataforma contiene validaciones preparadas de antemano y evaluaciones de la integridad de los datos, incluidos los metadatos y datos brutos pertinentes de BPx, en proyectos de validación de sistemas informatizados. Puede importar fácilmente escenarios de riesgo, requisitos y scripts de prueba de la biblioteca que aportarán elementos relacionados con la integridad de los datos, el control de acceso, la pista de auditoría, la firma electrónica, entre otros, para evaluar el proceso y los datos relacionados con los sistemas y/o procesos.
GO!FIVE® ayuda a aumentar el cumplimiento de la FDA 21 CFR Parte 11, y permite realizar proyectos de integridad de datos en el sistema, incluyendo la evaluación de registros en papel y electrónicos de las instalaciones del cliente.
- Modernización y facilitación de la inspección y el acceso a los datos relacionados con los proyectos de validación/cualificación
- Seguimiento automático y en tiempo real de todos los cambios
- Historial de cambios por comparación
- Una base de conocimientos que facilita el intercambio de mejores prácticas globales
- Potenciación de los equipos
- Integridad garantizada de principio a fin en los proyectos
- El sistema proporciona alertas tempranas de comportamientos extraños, como intentos de acceso simultáneos y ejecución de documentos en un orden distinto al de las guías de referencia
- Analice los datos en tiempo real y determine la mejor forma de seguir y mitigar sus escenarios de riesgo
- La Plataforma de Cumplimiento Digital no permite la firma retroactiva
- La DCP no permite el intercambio de pruebas una vez aprobada la ejecución de la prueba
- Alerte o bloquee la ejecución de secuencias de comandos de prueba con requisitos y/o escenarios de riesgo relacionados con la revisión/aprobación pendientes
- Conformidad con:
FDA 21 CFR Parte 211, 68, 188 y 192
EudraLex Vol. 4, Capítulo 4, Directrices
EudraLex Vol. 4, Anexo 17, Pruebas de liberación en tiempo real y liberación paramétrica
EudraLex Vol. 4, Capítulo 4, Directrices
MHRA Guidance on GxP data integrity (Orientaciones de la MHRA sobre la integridad de los datos GxP)
Guía de la OMS sobre buenas prácticas en la gestión de datos y registros
Si desea saber más sobre el software que ayuda a aumentar la integridad de los datos en su empresa, póngase en contacto con nuestros expertos en [email protected]
REFERENCIAS:
- Preguntas y respuestas de la EMA - Ago/2016; Preguntas y respuestas: Buenas prácticas de fabricación - Sección de integridad de datos
- FDA Guideline - Data Integrity and Compliance with Drug CGMP - Questions and Answers - Guidance for Industry - Dez/2018; Guía de la FDA sobre integridad de datos
- MHRA Medicine & Healthcare products Regulatory Agency MHRA - GXP Data Integrity Guidance and Definitions - Mar/2018; MHRA Data Integrity Definitions and Guidance
- PIC/S PI 041-1 Good Practices for Data Management and Integrity in Regulated GMP/GDP Environments - Jul/2021; Guía PIC/S
- WHO Guideline on data integrity, WHO TRS 1033, a partir de la página 135, 2021. Guía de la OMS




