¿Qué es Validación de Sistemas Informáticos y GAMP5® ?

¿Qué es Validación de Sistemas Informáticos?
La validación de sistemas demuestra documentalmente que los sistemas informáticos utilizados en la producción industrial cumplen adecuadamente con sus funciones automáticas y contribuyen a garantizar la trazabilidad de los lotes producidos. Cuando automatizados, deben cumplir los requisitos del FDA 21 CFR Part11, norma americana que preconiza ítems que cuando son atendidos, hacen el sistema seguro y susceptible de validación..
Todo sistema informático que tenga relación directa o indirecta con la producción del medicamento/producto que impacta en la salud del paciente o consumidor debe de ser validado.
La primera actividad importante del profesional de validación de sistemas informáticos es reunir toda la documentación disponible sobre el sistema objeto del estudio. A continuación, este profesional pasa a estudiar la documentación con el objetivo de identificar escenarios de riesgos. En equipo multidisciplinario, para cada escenario de riesgos levantado, se analizan los elementos involucrados.

¿Cómo surgió la Validación de Sistemas Informáticos ?
En la década de 1980, en los países europeos y en los Estados Unidos de América, la validación de sistemas informáticos comenzó a formar parte de la rutina de las industrias de ciencias de la vida, compuestas por farmoquímicas, farmacéuticas, veterinarias, cosméticas y productos médicos por una necesidad de establecer un mejor control de sus procesos productivos con más eficiencia.
Pero sólo en 1994, apareció en Inglaterra la primera versión del GAMP® (borrador todavía) Good Automated Manufacturing Practice - guía de validación de sistemas informáticos - difundido mundialmente y una de las principales referencias en esta área, actualmente en la versión 5 (GAMP5®).
La Validación de Sistemas Informáticos se basa en Escenarios de Riesgos
El estudio de la documentación existente para analizar los escenarios de riesgos es de suma importancia para conocer las particularidades del sistema a validar. Sin embargo, después de algunos sistemas validados por el profesional, algunos escenarios de riesgos se presentan invariablemente, como comportamiento del sistema ante caída de energía, estudio de los perfiles y seguridad de acceso, calidad del registro electrónico producido por el sistema incluyendo pista de auditoría, aplicación de firmas electrónicas, etc.

Es importante destacar que el Análisis de Riesgos tiene que ser realizado por equipo multidisciplinario, porque es muy común la necesidad de adoptar medidas de mitigación para los riesgos que resultan en niveles "medio" y "alto". La adopción de estas medidas tiene que ser acordada entre el equipo para que realmente funcionen, ya sean la adopción de nuevos procedimientos de trabajo o mejoras en el sistema. Las medidas que se adopten se convierten en la estrategia de validación y son los principales puntos en los que debe centrarse la validación.
* Para el Análisis de Riesgos, muchas veces es necesaria la participación del desarrollador del sistema. Cuando éste no está disponible, puede ser contratado un profesional con conocimientos sobre el tipo de sistema que está siendo analizado.
¿Por qué hacer Validación de Sistemas Informáticos?
Además de la necesidad de mantener un control más efectivo de sus procesos productivos, las agencias de vigilancia sanitarias de diversos países, alineadas con la OMS - Organización Mundial de la Salud - buscando proteger la salud de los consumidores de las industrias de ciencia de la vida detiene la misión de identificar y controlar rápidamente eventuales problemas en toda la cadena productiva desde el origen hasta el consumo. A continuación, exigieron la validación de los sistemas informáticos para garantizar la calidad de los productos industriales.

¿Cuáles son las ventajas de la Validación?
Además de la conformidad, el proceso de validación naturalmente provoca algunas mejoras para reducir riesgos al producto y/o paciente o consumidor y trae algunas ventajas interesantes al negocio, algunas de ellas:
• Utilización de todos los recursos disponibles en el sistema necesario para cubrir de forma segura el proceso en particular, incluso para mitigar riesgos planteados durante el trabajo de validación y/o calificación
• Hace que el equipo tenga conocimientos técnicos más profundos sobre el sistema (apertura de la "caja negra")
• Por estar basado en riesgos, la validación resuelve problemas antes de que éstos ocurran de hecho, evitando el reequilibrio en los lotes de producción - evita problemas de costo e imagen de la empresa en el recogimiento de lotes y mejora la productividad - ¡bueno para el negocio!
GAMP5®
GAMP5® es una guía de Buenas Prácticas de Fabricación Automatizada la quinta versión de la primera edición del manual fue publicada en 2008. Ya en 2022, se publicó la segunda edición de la guía. Desde entonces ha revolucionado el método de Validación de Sistemas Informáticos.
La guía es la principal fuente de "inspiración" para los profesionales de Validación de Sistemas Informáticos y trae como eje central, la estrategia de validar basada en riesgos ("A Risk Based Approach to Compliant GxP Computerized Systems").
GxP (BPx) es un término general para la aplicación de buenas prácticas (good practices). El método ‘x' indica el área en la que se relacionan las buenas prácticas (fabricación, distribución, investigación clínica, laboratorio, etc.). El sistema BPx es pertinente a cualquier sistema que tiene un impacto:
- Salud del paciente;
- Calidad del producto
- Integridad de datos
La mejor manera de validarlo es, sin duda, basada en riesgos, ya sea un sistema nuevo (validación prospectiva) o un sistema heredado (validación concurrente). Si el riesgo se traduce en niveles ‘medio’ y ‘alto’, una medida de mitigación debe ser prevista. Si la mitigación o actualización no es posible, el cambio del sistema debe ser considerado.

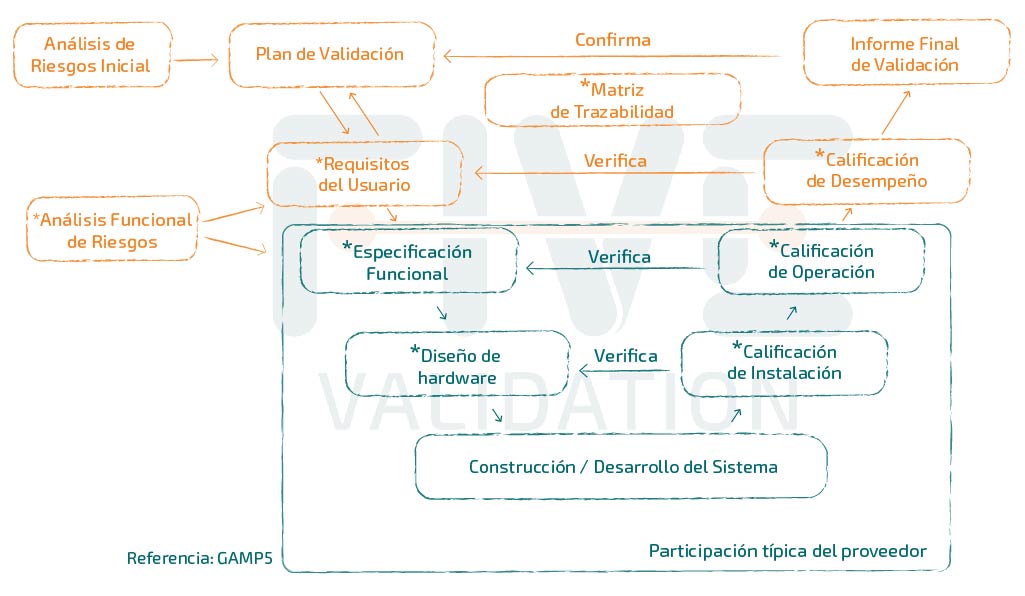
URS – User Requirement Specification
Normalmente, estas medidas de reducción del riesgo "medio" y "alto" se detallan en la revisión de la URS (User Requirement Specification), que es el documento de referencia de la validación de sistemas. Si el sistema es de estantería, básicamente deben realizarse pruebas que demuestren que los requisitos de la URS han sido cubiertos y algunas otras pruebas típicas de sistemas cubiertas en las fases de:
- Cualificación de la instalación;
- Cualificación de la operación
- Cualificación del desempeño
Si el sistema es configurado o personalizado para satisfacer las necesidades de la empresa usuaria, los documentos de especificaciones deben ser producidos. Algunos ejemplos de ellos:
- Calificación de Proyecto;
- Especificación Funcional;
- Diseño de Hardware;
- Diseño de Software.
La guía GAMP5® detalla el ciclo de vida exacto necesario para cada tipo de sistema y los separan de la siguiente manera:
CLASSIFICAÇÃO/CATEGORIZAÇÃO DE SISTEMAS COMPUTADORIZADOS
| GAMP® | Tipo |
|---|---|
| Categoría 1 | Infraestructura |
| Categoría 3 | Estante |
| Categoría 4 | Configurado |
| Categoría 5 | Personalizado |
Es importante señalar que adquirir el paquete de documentos del proveedor no significa la finalización del trabajo de validación. Es necesario "abrir" el ciclo de vida de los documentos, con emisión del Plan de Validación, Análisis de Riesgos y URS, y "cerrar" el ciclo de vida con la emisión del protocolo de pruebas de desempeño, Matriz de Trazabilidad e Informe de Validación, documentos que normalmente no forman parte del ámbito de aplicación del proveedor de la solución.
FDA 21 CFR Part 11
Es la norma de la FDA que establece reglas para uso de registro electrónico en las industrias de Ciencias de la Vida. En resumen, el sistema debe incluir:
• Archivos electrónicos o base de datos que garantice la integridad de los datos
• Pista de auditoría
• Control de acceso al sistema
• Firma electrónica = ID + contraseña
• Garantía de uso de cuentas por sus usuarios genuinos
• Métodos adecuados para impedir el acceso no autorizado
Los requisitos de la FDA 21 CFR Part11 son actualmente bastante comunes en el mercado y si se prevé desde el inicio del proyecto, trae la seguridad y trazabilidad necesaria para el buen uso del sistema. Para los sistemas heredados que no cumplen con la normativa, el mejor camino es el Análisis de Riesgos. Sugerimos estudiar justamente la ausencia de estas seguridades electrónicas.
La Integridad de los Datos
UUno de los principales requisitos en un sistema informático es asegurar que los datos generados en la producción sean íntegros del principio al fin del proceso.
Esto significa que el sistema debe ser capaz de mantener registros de quién entró en el sistema, cuándo, qué hizo, por qué lo hizo y de dónde lo hizo.
Por lo general, el impacto en la integridad de los datos está relacionado principalmente con esta trazabilidad de los datos del lote de producción (dependiendo del sistema de enfoque de la validación).
Pinche aquí para más informaciones sobre la Integridad de Datos en la Industria Farmacéutica




