O que é Validação de Sistemas Computadorizados? O que é GAMP5®?

O que é Validação de Sistemas Computadorizados?
A validação de Sistemas Computadorizados comprova documentalmente que os sistemas computadorizados utilizados na produção industrial cumprem adequadamente com suas funções automáticas e contribuem para garantir a rastreabilidade dos lotes produzidos. Quando automatizadas, devem cumprir as exigências do FDA 21 CFR Part11, norma americana que preconiza itens que quando atendidos, tornam o sistema seguro e passível de validação.
Todo sistema computadorizado que tem relação direta ou indireta com a produção do medicamento/produto para saúde ou impacto na rastreabilidade, têm que ser validado.
A primeira atividade importante do profissional de Validação de Sistemas Computadorizados é reunir toda a documentação disponível sobre o sistema objeto do estudo. Em seguida, este profissional passa a estudar a documentação com o objetivo de identificar cenários de riscos.
Clique aqui para conhecer nossos Treinamentos VSC remotos

Como surgiu a validação de sistemas computadorizados?
Na década de 80, em países europeus e nos Estados Unidos da América, a validação de sistemas computadorizados começou a fazer parte da rotina das indústrias da área de ciências da vida, compostas por farmoquímicas, farmacêuticas, veterinárias, cosméticas, produtos médicos por uma necessidade de estabelecer melhor controle de seus processos produtivos com mais eficiência. Mas somente em 1994, surgiu na Inglaterra a primeira versão do GAMP® (draft ainda) Good Automated Manufacturing Practice – guia de validação de sistemas computadorizados – difundido mundialmente e uma das principais referências nesta área, atualmente na versão 5 (GAMP5®).
A Validação de Sistemas Computadorizados é baseada em Cenários de Riscos
O estudo da documentação existente para levantamento dos cenários de riscos é de extrema importância para conhecer as particularidades do sistema a ser validado. Entretanto, após alguns sistemas validados pelo profissional, alguns cenários de riscos são invariavelmente apresentados, como comportamento do sistema perante queda de energia, estudo dos perfis de acesso, segurança de acesso, qualidade do registro eletrônico produzido pelo sistema incluindo trilha de auditoria, aplicação de assinaturas eletrônicas, etc.

É importante ressaltar que a Análise de Riscos tem que ser feita por equipe multidisciplinar, porque é muito comum a necessidade de adoção de medidas de mitigação para os riscos que resultam em níveis "médio" e "alto". A adoção destas medidas tem que ser acordada entre a equipe para que realmente funcionem, sejam elas adoção de novos procedimentos de trabalho ou melhorias no sistema. As medidas a serem adotadas se tornam a estratégia de validação e são os principais pontos onde a validação deve focar. * Para a Análise de Riscos, é necessária a participação do desenvolvedor do sistema. Quando este não está disponível, pode ser contratado um profissional com conhecimento sobre o tipo de sistema que está sendo analisado.
Por que fazer a Validação de Sistemas Computadorizados?
Além da necessidade de manter um controle mais efetivo de seus processos produtivos, as agências de vigilância sanitárias de diversos países, alinhadas com a OMS - Organização Mundial da Saúde – buscando proteger a saúde dos consumidores das indústrias de ciência da vida de tem a missão de rapidamente identificar e controlar eventuais problemas em toda a cadeia produtiva desde a origem até o consumo. Passaram então a exigir a validação de sistemas computadorizados como forma de garantir a qualidade dos produtos industrializados.No Brasil, a validação de sistemas computadorizados começou a ser regulamentada pela ANVISA no ano de 2005 para a indústria farmoquímica, mas foi no ano de 2010 que a regulamentação foi exigida para a indústria farmacêutica e posteriormente expandida para demais industrias de ciências da vida.
Clique aqui e saiba mais sobre o ciclo de documentos na validação

Quais as vantagens na validação?
Além da conformidade, o processo de validação naturalmente provoca algumas melhorias para baixar riscos ao produto e/ou paciente ou consumidor e traz algumas vantagens interessantes ao negócio, algumas delas: • Utilização de todos os recursos disponíveis no sistema necessário para cobrir de forma segura o processo em específico, inclusive para mitigar riscos levantados durante o trabalho de validação e/ou qualificação; • Torna a equipe detentora de conhecimento técnico mais aprofundado sobre o sistema (abertura da “caixa preta”); • Por ser baseado em riscos, a validação resolve problemas antes destes ocorrerem de fato, evitando retrabalho nos lotes de produção – evita problemas de custo e imagem da empresa no recolhimento de lotes e melhora produtividade – bom para o negócio!
GAMP5® Segunda Edição e Guia de Validação de Sistemas da ANVISA
A ISPE® (International Society of Pharmaceutical Engineering) desenvolveu o Guia GAMP (Good Automated Manufacturing Practice) para orientar a comunidade de Ciências da Vida a desenvolver validações robustas.
O GAMP5 é um guia de Boas Práticas de Manufatura Automatizada, a quinta edição do guia foi lançada em 2008 e recentemente, em 2022, foi lançada a segunda versão da publicação, trazendo insights que podem ser muito úteis ao negócio.
A principal fonte de “inspiração” para os profissionais de Validação de Sistemas Computadorizados e traz como eixo central, a estratégia de validar baseado em risco ("A Risk Based Approach to Compliant GxP Computerized Systems"). GxP é um termo geral para aplicação de boas práticas (good practices). O ‘x’ indica a área em que as boas práticas estão relacionadas (fabricação, distribuição, pesquisa clínica, laboratório, etc.).
O guia para Validação de Sistemas Computadorizados nº 33/2020 tem o GAMP5 como principal referência e traduz o termo GxP como BPx relevante. O sistema BPx relevante é todo e qualquer sistema que tem impacto:
- Saúde do paciente;
- Qualidade do produto;
- Integridade de dados.
A melhor forma de validar é sem dúvida, baseada em riscos, seja um sistema novo (validação prospectiva) ou sistema legado (validação concorrente). Se o risco resultar nos níveis ‘médio’ e ‘alto’, uma medida de mitigação deve ser prevista. Caso a mitigação ou upgrade não seja possível, a troca do sistema deve ser considerada.

URS – User Requirement Specification
Normalmente, estas medidas de mitigação de riscos “médio” e “alto” são detalhadas na URS (User Requirement Especification) que passa a ser o documento referência da Validação de Sistemas. Se o sistema for de prateleira, basicamente devem ser elaborados testes que comprovam que os requisitos da URS foram cobertos e alguns outros testes típicos de sistemas cobertos nas fases de:
- Qualificação de Instalação;
- Qualificação de Operação;
- Qualificação de Desempenho.
Se o sistema for configurado ou customizado para atender as necessidades da empresa usuária, documentos de especificações devem ser produzidos. Alguns exemplos:
- Especificação Funcional;
- Hardware Design; Software Design.
Tanto o GAMP5®, como o Guia da ANVISA detalham o ciclo de vida exato necessário para cada tipo de sistema e separam da seguinte forma:
CATEGORIZAÇÃO DE SISTEMAS COMPUTADORIZADOS
| GAMP®/ANVISA | Comentário |
|---|---|
| Categoria 1 | Infraestrutura |
| Categoria 3 | Prateleira |
| Categoria 4 | Configurado |
| Categoria 5 | Customizado |
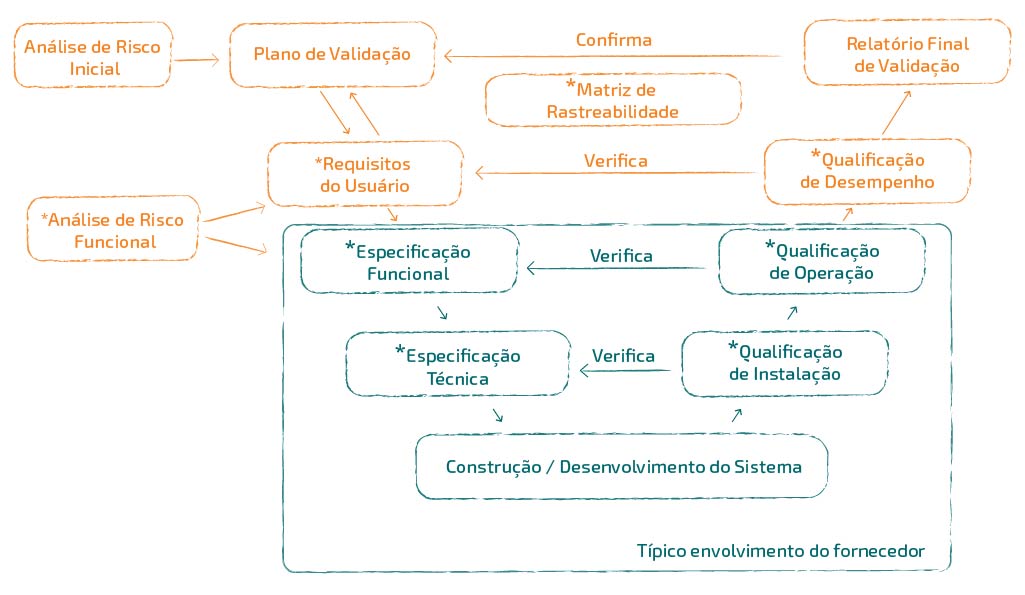
É importante ressaltar que adquirir o pacote de documentos do fornecedor não reflete a conclusão do trabalho de validação. É necessário “Abrir” o ciclo de vida de documentos, com emissão do Plano de Validação, Análise de Riscos e URS e “Fechar” o ciclo de vida com a emissão do protocolo de testes de Desempenho, Matriz de Rastreabilidade e Relatório de Validação, documentos que normalmente não fazem parte do escopo do fornecedor da solução.
Para esclarecer melhor, o fluxo ao lado mostra os documentos que devem ser previstos para a validação de um sistema ou equipamento de fábrica, configurado, categoria 4 da ANVISA. Neste exemplo, os documentos de especificação e protocolos de testes fariam parte do escopo do fornecedor:
FDA 21 CFR Part 11 e RDC 658/2022
FDA 21 CFR Part 11 é a norma do FDA que estabelece regras para utilização de registro eletrônico nas indústrias de Ciências da Vida. No Brasil, as regras passaram a ser adotas quando a ANVISA publicou a RDC 17/2010, atualmente a versão RDC nº 658 de 30/03/2022 encontra-se vigente.
De forma bastante resumida, o sistema deve contemplar:
• Arquivos eletrônicos invioláveis ou banco de dados que garantam integridade de dados;
• Trilha de auditoria;
• Controle de acesso ao sistema;
• Assinatura eletrônica = ID + senha;
• Garantia de uso de contas por seus usuários genuínos;
• Métodos adequados para impedir o acesso não autorizado.
Os requisitos do FDA 21 CFR Part 11 são atualmente bastante comuns no mercado e se previstos desde o início do projeto, traz a segurança e rastreabilidade necessária para o bom uso do sistema. Para sistemas legados que não atendem o regulamento, o melhor caminho é a Análise de Riscos. Sugerimos estudar justamente a ausência destas seguranças eletrônicas.
A Integridade dos Dados – Data Integrity
Um dos principais requisitos em um sistema computadorizado é garantir que os dados gerados na produção estejam íntegros do início ao fim do processo. Isso quer dizer, que o sistema deve ser capaz de manter os registros de quem entrou no sistema, quando, o que fez, porque fez e de onde fez. Normalmente, o impacto na integridade de dados está principalmente relacionado a essa rastreabilidade de dados de lote de produção (dependendo do sistema foco da validação). Clique aqui para mais informações sobre a Integridade de Dados na Indústria Farmacêutica
Em alguns setores da indústria nacional, como por exemplo, o farmacêutico e o farmoquímico a validação de sistemas computadorizados é uma exigência regulatória, e uma tendência em outros, como a veterinária. Mesmo que a legislação nacional não exija a validação de sistemas computadorizados para algumas indústrias, quando a intenção é exportação, existem vários países onde a validação é obrigatória para determinados segmentos, como é o caso da indústria veterinária.
Clique aqui e conheça nosso software de validação remota, o GOFIVE®
GAMP5® é um guia que tem seus direitos intelectuais reservados à ISPE. Disponível para aquisição no site ispe.org.





