Conociendo los Retos Regulatorios de los Startups de Dispositivos Médicos y Tecnología de la Salud: Adoptando la Validación Ágil y Digital para un Tiempo de Comercialización Más Rápido

El camino hacia el crecimiento de un startup implica numerosos obstáculos y etapas, particularmente para aquellos que operan en mercados regulados como dispositivos médicos y tecnología de la salud.
Uno de los mayores retos que enfrentan es determinar el momento apropiado para lanzar su producto, teniendo en cuenta factores como la innovación, el desarrollo y la regulación.
Sin validación, las industrias biofarmacéuticas y de dispositivos médicos no pueden registrar ni producir sus productos.
Los startups y scaleups deben adherirse a los mismos estándares regulatorios y de validación que las grandes corporaciones, pero con una fuerza laboral significativamente menor. Por lo general, los startups no tienen la experiencia interna o los recursos para pagar a los consultores en las primeras etapas.
En la etapa inicial, la mayoría de los startups carecen del conocimiento y la experiencia en cumplimiento normativo, lo que puede consumir recursos valiosos como tiempo, dinero y energía, arriesgando la pérdida de toda su inversión.
En un conocido estudio realizado por McKinsey & Co., se reveló que un producto retrasado seis meses antes de llegar al mercado experimenta una pérdida significativa del 33% en ganancias durante un período de cinco años.
Alternativamente, en un escenario diferente, cuando el mismo producto se lanza según lo planeado, pero con un coste presupuestario del 50% a más, el impacto en las ganancias es considerablemente menor, con solo una reducción del 4% en el mismo período de cinco años.
En resumen:
Escenario 1:
Presupuesto: Dentro de lo planeado
Tiempo: Seis meses después de la fecha programada
Impacto: reducción del 33% en los beneficios en cinco años
Escenario 2:
Presupuesto: 50% más sobre lo planeado
Hora: Lanzado en la fecha programada
Impacto: reducción del 4% en los beneficios en cinco años
Seguramente es posible imaginar la ganancia que se obtiene cuando reducimos el tiempo de disponibilidad de un producto al mercado, sin dejar de lado la calidad y el cumplimiento dentro del presupuesto. Esta es la razón por la cual la velocidad en las actividades de validación es una ventaja competitiva.
No hay que olvidar que, además del período de innovación, existe el esfuerzo de documentación, que también puede llevar una cantidad considerable de tiempo desde el proyecto.
Esto se vuelve aún más peligroso teniendo en cuenta que los startups generalmente no generan ingresos todavía. Por lo tanto, tal impacto puede incluso significar el fin de la empresa.
Teniendo esto en cuenta, es muy recomendable que los startups regulados apliquen una cultura de pensamiento crítico alineada con los principios de Gestión de Riesgos de Calidad ICH Q9, que básicamente apoya la toma de decisiones informadas y el buen juicio sobre el alcance y la profundidad de las actividades (por ejemplo: nivel de formalidad de documentación).
Como se mencionó anteriormente, sin validación no es posible hacer que los productos biofarmacéuticos y los dispositivos médicos estén disponibles en el mercado. Por lo tanto, agilizar el proceso puede ser clave para marcar la diferencia en un startup.
Además, es del conocimiento común que los pioneros del mercado disfrutan de algunas ventajas en términos de cuota de mercado, ingresos y crecimiento económico.
Los startups también pueden obtener conocimientos de los consultores, aprender mientras están operando y desarrollar a los empleados. Sin embargo, considerar lo antes posible el enfoque digital permite que los recursos se centren en tareas de mayor valor: más tiempo para innovar y desarrollar nuevos procesos, y todo el equipo tendrá calidad comprometida, ya que los datos son fácilmente accesibles y los requisitos son claros y listos para usar.
¿Qué es GAMP5®, segunda edición y CSA?
Las empresas de Ciencias de la Vida, en particular las de productos biofarmacéuticos y dispositivos médicos, operan en un entorno altamente regulado donde es crucial demostrar los procesos de desarrollo y la consistencia de sus productos.
Cada startup en estas industrias debe mantener procedimientos para el control del diseño del producto para garantizar que se cumplan los requisitos especificados para el proyecto. La validación juega un papel vital en este proceso al generar evidencia de que el producto satisface a las necesidades del usuario y la indicación de uso. La validación del diseño incluirá la validación del software, cuando proceda.
Durante la fase inicial, la validación del proyecto tiene una importancia significativa. Sin embargo, a medida que la empresa avanza y se acerca a la etapa de obtención del certificado de Buenas Prácticas de Fabricación (BPF), pueden ser necesarias validaciones adicionales. Estas validaciones pueden abarcar hojas de cálculo, sistemas y equipos que impactan la calidad del producto, la integridad de los datos o la seguridad de los pacientes y/o consumidores.
Para guiar a la comunidad de Ciencias de la Vida en el desarrollo de validaciones consistentes, la Sociedad Internacional de Ingeniería Farmacéutica, ISPE®, creó la Guía GAMP® (Good Automated Manufacturing Practice, ahora en la segunda edición).
La Guía GAMP5® fomenta las herramientas de software para apoyar las prácticas ágiles que pueden mejorar el enfoque tradicional de la documentación que puede introducir riesgos de incumplimiento debido a la dificultad de rastrear la documentación en papel.
Además, la guía Computer Software Assurance (CSA) de la FDA, que se publicó en forma de borrador en septiembre de 2022, se centra en garantizar la calidad del software utilizado en el proceso de fabricación y la garantía de calidad de los dispositivos médicos.
A pesar de las diferencias en sus directrices, GAMP5® y CSA comparten una sinergia interesante con respecto al alcance de las pruebas. Ambas guías sugieren o recomiendan tipos similares de pruebas guiadas y no guiadas, lo que indica una comprensión común de la importancia de garantizar la seguridad y eficacia de los productos de Ciencias de la Vida.
En resumen, ambas guías abogan por el pensamiento crítico y enfatizan la utilización de herramientas de software. Si bien CSA no se centra principalmente en evaluar el riesgo del paciente, GAMP5® se destaca como una metodología sólida que goza de aceptación universal entre las agencias reguladoras de todo el mundo. En consecuencia, puede y debe considerarse como una excelente guía para validar el software del producto terminado.
Waterfall vs Ágile
En la industria de las Ciencias de la Vida, es común utilizar el modelo Waterfall, en cascada, para la entrega de proyectos, a menudo debido a la carga de trabajo involucrada en la validación manual en papel o digital (basada en un editor de texto).
Con el desarrollo de software Waterfall, hay un flujo lineal de definición/recopilación de todos los requisitos antes de transformarlos en un conjunto completo de especificaciones funcionales y de diseño que se codifican/configuran antes de que comiencen las pruebas.
Sin embargo, este enfoque puede dar lugar a retrasos sustanciales, extendiendo el tiempo requerido para la liberación y lanzamiento de innovaciones a varios trimestres o incluso años. Un proyecto estándar de dispositivos médicos de investigación y desarrollo ya abarca varios años. Sin embargo, sin una estrategia de validación preconcebida, este cronograma puede extenderse aún más.
Además de que la validación/calificación es un requisito para el registro y comercialización de productos, un conjunto consistente de documentos puede obtener su aprobación más rápido y sin ajustes al hacer que los organismos reguladores entiendan mejor la innovación propuesta por su producto.
En otro estudio publicado por McKinsey & Company, un sistema de calidad inteligente puede tener un impacto tangible en las ganancias y acelerar el tiempo de comercialización en más del 30% y aumentar la capacidad de producción de la cadena de suministro en un 20-30%.
La calidad inteligente combina tecnologías avanzadas, estandarización, procesos y formas flexibles de trabajo que están totalmente alineadas con el marco Ágile.
Con el desarrollo de software ágil, los requisitos se recopilan y luego se trasladan al desarrollo/configuración, pruebas y lanzamiento en ciclos iterativos.
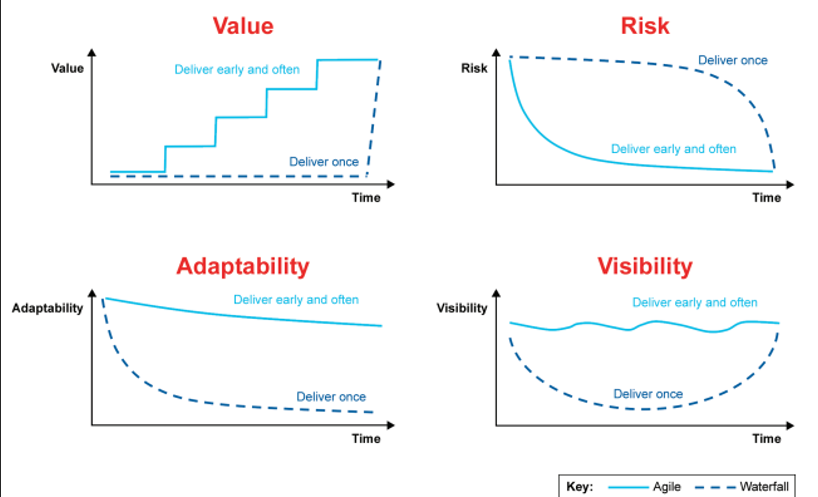
No son los enfoques lineales los que son el problema, sino que no están experimentando cambios constantes. Para lograr esta mentalidad, los objetivos a largo plazo deben ser considerados, pero el progreso hacia ellos debe ser a través de pequeños cambios efectivos.
PINCHE AQUÍ para obtener más información sobre los conceptos ágiles y cómo pueden ayudar a agilizar la entrega de proyectos en la industria de las Ciencias de la Vida.
Conociendo el Panorama Regulatorio: Un Enfoque Estratégico para Startups y Scaleups
Si bien la transición de una etapa a otra (descubrimiento, diseño y construcción, lanzamiento, escalonamiento y establecimiento) puede ser un desafío, varios enfoques pueden ser aplicados para lograr este objetivo.
Tener parceros de confianza que comprendan el mercado es crucial para que los startups ahorren tiempo y dinero, independientemente de la etapa en que estén.
Además, adherirse y conocer los requisitos de BPx (impacto en las buenas prácticas) establecidos por organismos reguladores como la FDA, la EMA y la OMS desde el principio hará que la solución se construya de manera controlada.
Teniendo esto en cuenta, hemos creado el programa GO!STARTUP que proporciona un paquete completo que ofrece software, capacitación, soporte y horas de consultoría para ayudarlo a cumplir con los requisitos de validación de la FDA, la EMA y la OMS, 6 veces más rápido.
Como resultado, entrar en un mercado altamente regulado debe verse como una estrategia en lugar de un conjunto de tácticas desconectado.
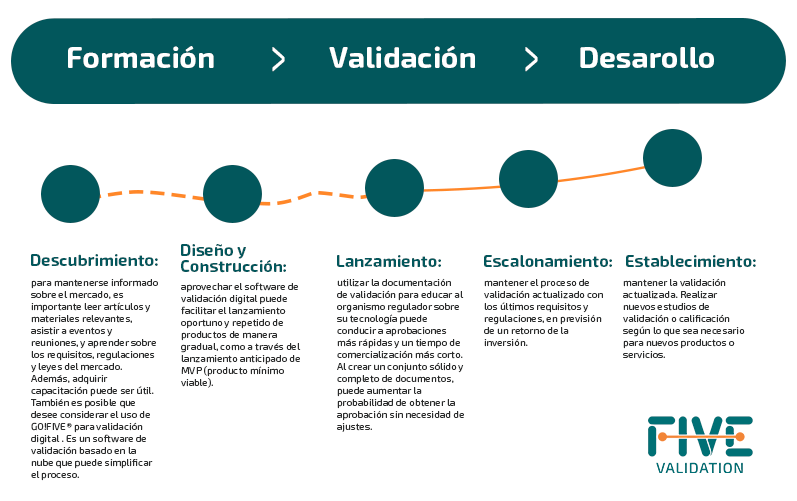
La Importancia de la Validación Digital en las Fases Pre-Seed y Seed de Inversión para Startups
Se recomienda participar en la lectura intensiva de artículos y materiales, así como en eventos y reuniones que cubran la fase de inversión Pre-Seed.
Es crucial familiarizarse con las regulaciones de los países donde planee comercializar su producto.
En esta etapa, obtener capacitación puede proporcionar conocimientos y habilidades valiosas a un costo relativamente bajo.
En esta fase, es crucial identificar los riesgos y oportunidades de mercado así como los productos que pueden servirle, como se ejemplifica a continuación:
Realizar la validación en papel conlleva varios riesgos, tales como:
- Falta de contenido de validación y referencias;
- Posible rechazo de documentación por parte de los agentes reguladores por falta de consistencia;
- Mayor tiempo de comercialización que resulta en pérdida de ingresos;
- Flexibilidad limitada en versiones y cambios debido a plantillas de documentos restringidas y prescriptivas.
Si opta por la validación digital que cumple con el marco ágil con GO!FIVE®, puede aprovechar varias oportunidades, que incluyen:
- Entregar valor pronto con lanzamientos tempranos y recurrentes, lo que lleva a un MVP temprano;
- Obtener aprobaciones más rápidas con un conjunto consistente de documentos, lo que resulta en ventajas de tiempo de comercialización;
- Mejorar la visibilidad tanto para el personal como para los clientes;
- Explicar la tecnología involucrada;
- Lograr un retorno de la inversión por adelantado.
No es raro, especialmente cuando se trata de conceptos verdaderamente innovadores, encontrar elementos imprevistos o desconocidos que requieren ajustes en el proyecto.
Es por eso que impulsar la adaptabilidad y la capacidad de respuesta a las necesidades cambiantes es altamente estratégico desde la fase Seed en delante.
Al implementar la validación digital en la fase de diseño y construcción, esta adaptabilidad se convierte en una ventaja competitiva, ya que es ampliamente reconocido que los primeros usuarios en el mercado pueden beneficiarse de mayor cuota de mercado, ingresos y crecimiento económico.
Los hospitales que poseen certificaciones de mejores prácticas pueden exigir la presentación de documentación de validación de productos para dispositivos médicos con software integrado, como máquinas de rayos X, ultrasonido, tomografía computadorizada o resonancia magnética. Mantener una documentación exhaustiva y actualizada puede dar una ventaja competitiva.
Teniendo esto en cuenta, el software GO!FIVE® permite realizar lanzamientos parciales por sprint y proporciona la flexibilidad de realizar cambios dinámicos en el contenido de estos lanzamientos si es necesario durante el proyecto.
Además, la función para liberar y versionar elementos por separado facilita el mantenimiento de su estado validado al tiempo que trata los elementos nuevos y existentes de manera diferente.
Revisar la validación es un proceso recurrente que debe realizarse con cada nueva versión de software y cambio de proceso. Sin embargo, el sistema consolida los cambios y versiones de estos elementos.
Al hacerlo, el startup puede mantener automáticamente la trazabilidad de cada etapa del proceso, eliminando la confusión causada por versiones obsoletas y la necesidad de resaltar cada nuevo cambio, ahorrando así más tiempo para dedicarse a otras actividades.
Usando GO!FIVE®, se puede mantener un registro completo de todos los cambios realizados sin dejar de tener una visión general clara de lo que está actualmente en vigor mediante la generación de estos entregables.
Este enfoque es particularmente beneficioso para aquellos que buscan mantener la documentación organizada y actualizada del proyecto.
¿Quiere Iniciar sus Validaciones Digitales?
La utilización de nuestra base de datos, que tiene más de 15 años de experiencia en el campo, puede ayudar a ahorrar tiempo y dinero que de otro modo se gastarían en la creación y el mantenimiento de documentos de validación.
Además de la amplia base de conocimientos del sistema, se puede buscar la ayuda de nuestros expertos para iniciar y desarrollar rápidamente sus proyectos de validación/calificación.
¿Quiere hablar con nuestros especialistas? PINCHE AQUÍ para programar una reunión.
Sobre la autora: Lilian Ribeiro
Ella tiene casi cuatro años de experiencia técnica en la industria alimentaria, especializada en calidad corporativa/control de calidad. Además, tiene tres años de experiencia técnica y comercial en los sectores sanitario/farmacéutico.
Como entusiasta de la validación sin papel, le apasiona brindar eficiencia e innovación a las empresas de Ciencias de la Vida.
Su experiencia radica en proyectos de validación y calificación, incluidos VLMS, ERP, EQMS, automatización (PW) y calificación de infraestructura de TI.
Sobre la revisora: Silvia Martins
Es ingeniera eléctrica con 20 años de experiencia al servicio de empresas biofarmacéuticas y de dispositivos médicos. Recibió capacitación en GAMP5 y FDA 21 CFR Parte 11 en Inglaterra, Validación de SAP® en Alemania e Integridad de datos y Gobernanza de Datos en Dinamarca.
Como CEO y cofundadora de FIVE Validation, una compañía dedicada a agilizar los procesos de cumplimiento, está comprometida a hacer que éste sea más rápido y simple para los clientes.
Sobre el revisor: Rodrigo Olmedo, de uGlobally
Rodrigo Olmedo es un empresario brasileño con experiencia en marketing y negocios internacionales. Fue cofundador de dos compañías, incluida uGlobally, una organización enfocada en ayudar a las compañías tecnológicas a expandirse globalmente. Rodrigo ha trabajado con más de 600 actores influyentes del ecosistema y startups de más de 40 nacionalidades, apoyando a gobiernos, corporaciones y compañías tecnológicas en diversos aspectos de la expansión internacional. Además, Rodrigo se desempeña como asesor de negocios, orador en eventos, facilitador en proyectos europeos y mentor de programas de aceleración en todo el mundo.
Referencias:
GAMP5® 2nd edition 2022
ISPE GAMP® Good Practice Guide: Enabling Innovation – Critical Thinking, Agile, IT Service Management.
https://www.forbes.com/sites/steveblank/2018/10/08/what-startups-need-to-know-about-regulated-markets/?sh=14b938fc70cd
https://www.sipa.columbia.edu/news/experts-discuss-startups-and-regulated-markets
https://inatel.br/blog/empreendedorismo/252-quero-iniciar-uma-startup-por-que-devo-fazer-a-ideacao
https://hackmed.com.br/blog/fases-de-uma-startup/
https://www.mckinsey.com/industries/life-sciences/our-insights/smart-quality-reimagining-the-way-quality-works
SAP® es una marca registrada de SAP® en Alemania y otros países. Todos los derechos reservados. Para obtener más detalles, acceda https://www.sap.com/corporate/en/legal/trademark.html
GAMP5® es una guía que tiene sus derechos intelectuales reservados por ISPE™. Disponible para su compra en https://ispe.org/



